- 首页 > 科研服务 > 空间转录组分析+单细胞分选与分离
空间转录组分析+单细胞分选与分离
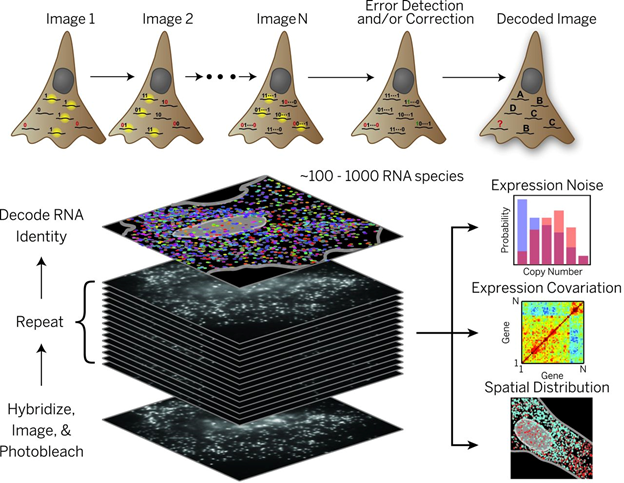
“空间转录组技术”被Nature Methods杂志评为2020年年度技术。这不是一个新的概念,这是一项紧跟着高通量单细胞转录组技术发展起来的前沿技术。当我们讨论基因表达模式的时候,我们往往会关注两个维度:空间维度 (temporal) 和时间维度(spatial)。
目前研究空间转录组的技术非常多(见下图),概况起来有4种解析“空间性转录组”的策略(如封面图):
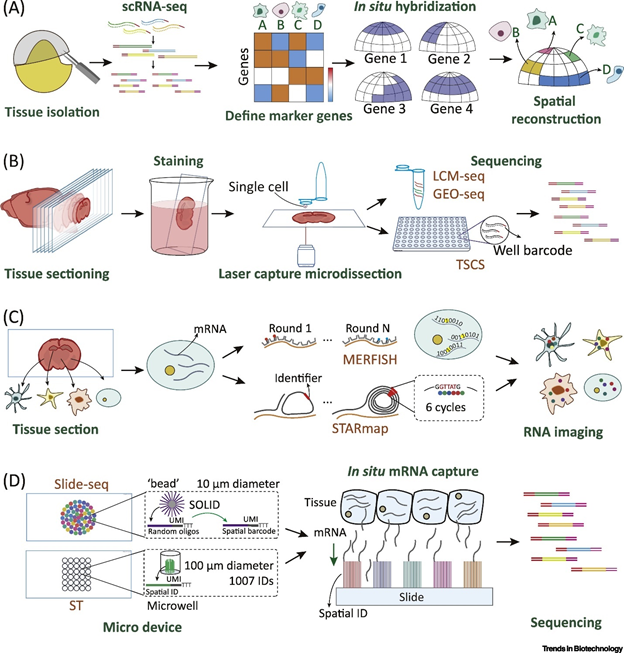
第一种方法,根据单细胞转录组数据并结合marker gene的原位杂交实验数据,利用计算机来模拟重构组织的空间形态。例如Satija 和他同事提出的Seurat,这是一个在单细胞数据分析中广泛用到的R包,我们可以利用scRNA-seq数据,结合FISH数据提供的marker gene位置信息,绘制出marker gene在正在组织区域的表达强度分布,最终每个单细胞通过marker gene表达谱(expression profiles)和强度分布(expression densities)而被定位还原组织中的特定位置;
第二种方法,即结合激光显微切割+测序(LCM-seq)。这种技术对仪器和实验人员的操作要求较高,而且获取的通量也比较低,例如Casasent和他的同事开发了topographic single cell sequencing (TSCS)技术来比较单个细胞基因组结构差异。具体是组织制片侯,用H&E染色,这样在显微镜下就可以识别单个细胞核了,LCM可以以此来捕获单个细胞了,虽然繁琐通量低,但是仍然可以获得单个细胞转录组和基因组信息;
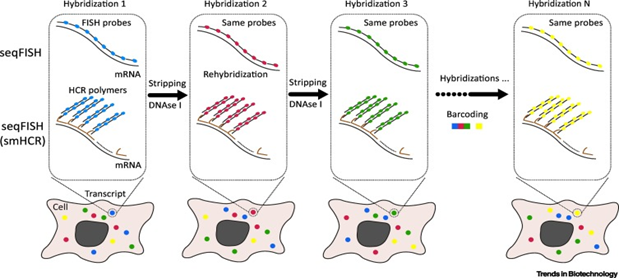
第三种策略,就是基于高分辨图像的原位转录组测序(Image-Based In Situ Transcriptomics)。代表性的是single-molecule FISH(smFISH),这是是空间组技术“基于杂交方法的开端”。最初用FISH仅同时在亚细胞学水平定性定量检测分析3-4个mRNA转录本。显然,不能满足对检测通量的期望,随后多通道的multiplexed smFISH开始发展,例如Expansion FISH (ExFISH)可以检测到8个基因,ouroboros single-molecule FISH (osmFISH) 可以检测到33个基因。在2020年,2个研究小组,通过对单细胞每个mRNA打标签(barcoding)的技术,进一步提高了通量。其一是Sequential FISH (seqFISH),通过多轮杂交检测单个细胞中barcoded mRNA,这样在单个固定的细胞中可以检测到>10,000个基因。
科学家们致力于捕获阵列中的单个细胞信息。瑞典皇家理工学院(KTH)说,这个方法的分辨率可以达到100 微米,即10个细胞。该技术面临着许多挑战,mRNA可能朝多方向扩散,会造成不准确的空间数据或混合表达模式的风险。
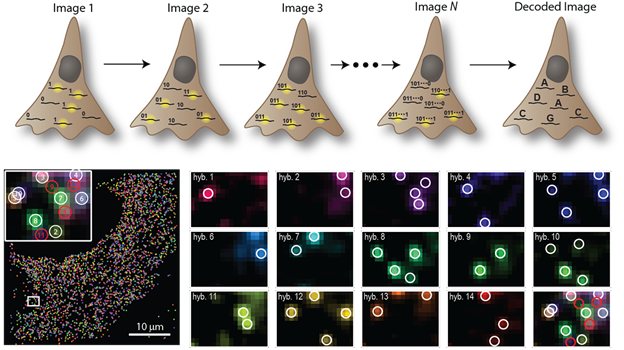
其二是哈佛大学化学和物理双料正教授庄小威(她领导的实验室,发明了STORM,Stochastic optical reconstruction microscopy,STORM 和 PALM,Photoactivated localization microscopy,同时首创了基于单分子的超高分辨率成像方法。)发明的MERFISH(multiplexed error-robust fluorescence in situ hybridization)。首先把细胞里面的每一种 RNA分子 确定一个二进制的标码,然后把它做标记,标记就能显示它的二进制标码。在第一个回合读的过程中,我们只标记那些 RNA 二进位第一位标码是 1 的,而第二个回合我们只需要读那些第二位标码是 1 的,这样依次下去。读到 N 位以后,每个细胞里面有很多点,每一个点代表的都是 RNA 分子。这样就变成一个很简单的数学问题,如果读了 N 位以后,你能够区分 2 的 N 次方种不同的 RNA。
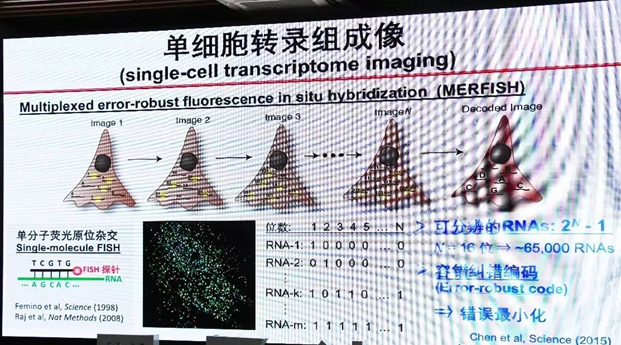
(引用自https://www.sohu.com/a/153208242_688647 )
第四种策略,就是“基于空间条形码(spatial barcodes)的空间转录组技术。2017年,10X公司收购了“空间转录组“公司,并且将这项技术进行了商业化。接下来我来简单介绍一下这个10X Genomics Visium产品的工作流程。
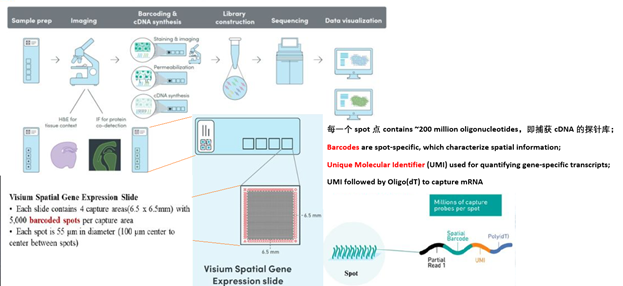
如上图,一张 玻片上对应的4个捕获区域可以构建4个空间文库,单个捕获区域大小为6.5 mm × 6.5 mm,约5,000个 spots,单个 spot 直径为55 μm, spot 与 spot 中心之间的距离为100 μm,每个 spot 含有独一无二的条形码(spatial barcode)来标记空间位置信息,且连接着 UMI 和 poly(dT)来捕获靶区域内的 RNA,实现反转录,扩增,和建库测序一系列步骤。
总结说来,正如瑞典皇家理工学院(KTH)生命科学实验室的Joakim Lundeberg及其同事指出,空间组技术可以分为两类,
一类是通过光学显微直接揭示组织的基因表达;
另一类是涉及原位杂交、原位测序、原位捕获并通过计算机分析从而重构空间数据的技术;
空间分析尚无法提供所有单个细胞范围的转录组信息,但该领域正朝着单个细胞的方向快速发展。空间转录组学是单细胞scRNA-seq后的下一波热潮,这对人类疾病的研究特别有用,因为人类疾病通常始于单细胞,并在时空上的扩散。
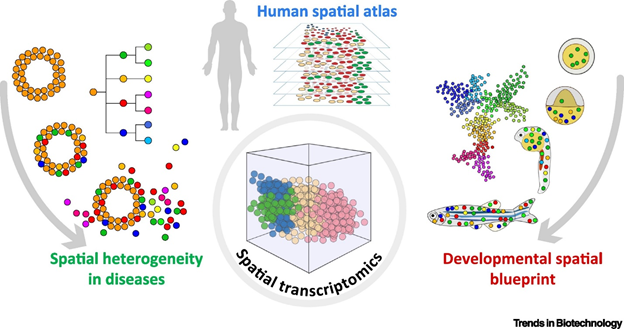
备注:全文信息来源,见https://www.sciencedirect.com/science/article/pii/S0167779920301402
https://science.sciencemag.org/content/348/6233/aaa6090
单细胞分选与分离(FACS细胞流式分选/半自动手动挑选)
流式细胞分选技术( fluorescence activated cell sorting,FACS)的应用非常广泛, FACS 可以高通量、高效的将目标单细胞样本回收到 96 孔板或 384 孔板中,与高通量、标准化实验操作兼容。如果与高通量、标准化实验操作兼容。
缺点是 FACS 对细胞有一定损伤,对 起始 细胞数量有一定要求,细胞数量较少的细胞亚群或珍贵样本不适合使用 FACS 进行单细胞回收。例如CTC细胞,我们另有合作伙伴的专利技术解决。
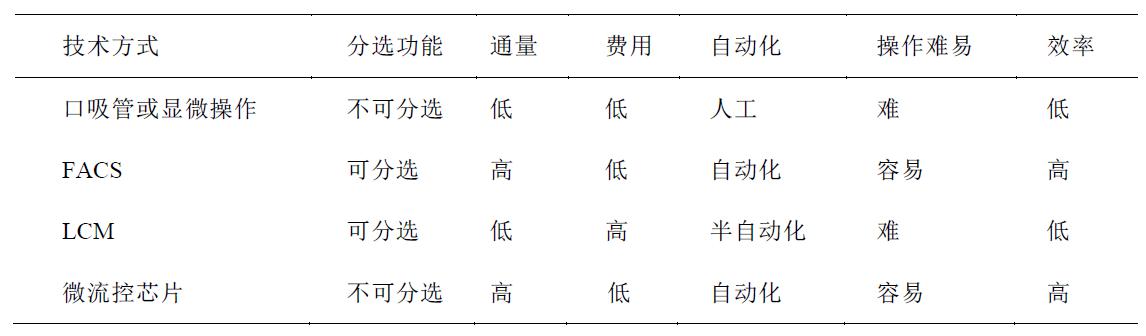
王卓等(2021)单细胞基因组测序技术新进展及其在生物医学中的应用[J]. 遗传, doi: 10.16288/j.yczz.20-363.
服务代码:4base-iso-SC
订购指南:order@4basedx.com


